Алканы – углеводороды с общей формулой: С n H 2n+2 ,
в молекулах которых атомы связаны одинарными связями.

Метан
Пропан
Этан
Бутан
Структурная формула пропана

S Р 3 – гибридизация
Валентный угол -109 о 28
Тетраэдр
Длина углерод – углеродной связи: 0,154 нм


Алканы с большим числом атомов углерода имеют зигзагообразное строение
Модель молекулы пентана

Различия в порядке соединения атомов в молекулах (т. е. в химическом строении) приводят к структурной изомерии . Строение структурных изомеров отражается структурными формулами. В ряду алканов структурная изомерия проявляется при содержании в цепи 4-х и более атомов углерода, т. е. начиная с бутана С 4 Н 10 .
С С
С С С С С С С С
С С
2,2 диметилбутан
2,3 диметилбутан

Все алканы плохо растворимы в воде. С ростом молекулярной массы закономерно увеличиваются температуры кипения и плавления.
Начиная с гексадекана появляются твёрдые алканы.

1 – выделение углеводородов из природного сырья
2- гидрирование циклоалканов и непредельных углеводородов
4- синтез Вюрца
5- гидролиз карбидов

Реакции гидрирования
Циклоалканов:
С 5 Н 8 + Н 2 = С 5 Н 10
Алкинов:
С 2 Н 2 + 2Н 2 = С 2 Н 6
Алкенов:
С 2 Н 4 + Н 2 = С 2 Н 6
Алкадиенов:
С 4 Н 6 + 2Н 2 = С 4 Н 10
+ Н 2

Получение метана при сплавлении ацетата натрия со щелочью :
CH 3 COONa + NaOH CH 4 + Na 2 CO 3
ацетат натрия метан
Свойства метана:
1) метан не вступает в реакцию окисления при действии водного раствора KMnO 4 ;
2) метан не вступает в реакцию с раствором брома;
3) горение метана:
CH 4 + 2О 2 СО 2 + 2Н 2 О + Q

Синтез Вюрца
проводят с целью получения алканов с более длинной углеродной цепью.
Например: получение этана из метана
1 этап. Галогенирование исходного алкана
СН 4 + С l 2 = CH 3 Cl + HCl
2 этап. Взаимодействие с натрием
2CH 3 Cl + 2 Na = C 2 H 6 + 2NaCl

Метан в лаборатории можно получить гидролизом карбида алюминия
Al 4 C 3 + 12 H 2 O = 4 Al(OH) 3 + 3 CH 4

1- реакции замещения
2- реакции дегидрирования
3- реакции горения
4 - реакции изомеризации
5- термическое расщепление

Хлорирование метана:
CH 4 + Cl 2 = CH 3 Cl +HCl
CH 3 Cl + Cl 2 = CH 2 Cl 2 +HCl
CH 2 Cl 2 + Cl 2 = CHCl 3 + HCL
CHCl 3 + Cl 2 = CCL 4 + HCL
Пример реакции замещения:
Взаимодействие декана с бромом
С 10 Н 22 + Br 2 = С 10 Н 2 1 Br + HBr

При дегидрировании алканов образуются алкены и другие непредельные углеводороды.
Например, дегидрирование пентана:
С 5 Н 10 С 5 Н 8 + Н 2
пентен

Все алканы горят с образованием углекислого газа и воды
Например: горение бутана
2С 4 Н 10 + 13О 2 = 8СО 2 + 10Н 2 О

Реакции изомеризации идут при нагревании и в присутствии катализатора
Например: изомеризация пентана (с хлоридом алюминия)
СН 3 -СН 2 -СН 2 -СН 2 -СН 3 СН 3 -СН-СН 2 -СН 3
СН 3

Термическое расщепление
1- крекинг (400-500 о С)
Алкан новый алкан и алкен
С 20 Н 42 С 10 Н 22 + С 10 Н 20
2- пиролиз метана при 1000 о С
СН 4 С + 2Н 2
3- получение ацетилена при нагревании до 1500 о С
2СН 4 С 2 Н 2 + 3Н 2

Получение растворителей
Получение ацетилена
А также сырьё для синтезов спиртов, альдегидов, кислот.
Горючее для дизельных и турбореактивных двигателей
В металлургии


- Какие углеводороды относят к алканам?
- Запишите формулы возможных изомеров гексана и назовите их по систематической номенклатуре.
- Напишите формулы возможных продуктов крекинга октана
4. В каком объёмном соотношении смесь метана с воздухом становится взрывоопасной?
5. Каковы природные источники получения алканов?
6. Назовите области применения алканов
ТЕСТ

ОТВЕТЫ К ТЕСТУ:
Рассматривает возможность протекания реакций алканов, сопровождающихся отщеплением части молекулы. Как называются подобные реакции?
При нагревании до температуры выше 500° в молекулах алканов происходит разрыв связей между атомами углерода. И могут образоваться углеводороды с меньшей молярной массой. Не только алканы, но и алкены. Этот процесс называется термическим крекингом (от англ. tocrack– «колоть, расщеплять»).
C 10H22---------C5H12+C5H10
C10H22---------C4H10+C6H12
В результате крекинга образуется смесь алканов и алкенов с меньшим количеством атомов углерода в молекулах, чем у исходного углеводорода. Чем выше температура крекинга, тем более легкие углеводороды образуются в результате.
В настоящее время в промышленности крекинг проводят чаще всего, используя катализаторы. В качестве катализаторов обычно применяют алюмосиликаты.
Каталитический крекинг протекает при более низких температурах, чем термический, и при этом происходит не только простое расщепление углеводородов, но и перестройка их углеродного скелета или изомеризация. В результате образуются углеводороды с более разветвлённым скелетом, чем исходные.
(каталитический крекинг – схема)
Это важно для повышения качества топлива. Каталитический крекинг углеводородов нефти – один из промышленных способов повышения октанового числа бензина. При увеличении температуры можно достичь такой степени протекания реакции, при которой органические вещества – углеводороды – полностью разлагаются на углерод и водород. Такой процесс называется пиролизом.
При пропускании нагретого алкана над платиновым или никелевым катализатором может отщепиться водород. Этот процесс называется дегидрированием.
В результате этой реакции получаются непредельные углеводороды - алкены. Есть еще один важный процесс, при котором алканы, содержащие более 6 атомов углерода, нагревают над сложным катализатором. Этот катализатор обычно состоит из алюмосиликатов с добавкой платины. В результате отщепляется водород и образуются ароматические углеводороды – арены. Такой процесс называют риформингом
Его, так же, как и крекинг, используют в промышленности для получения бензина с высоким октановым числом.
Есть еще важная для промышленности реакция алканов – конверсия.
СН4+Н2O CO+3H2
Так называют взаимодействия алканов, из которых чаще всего используют природный газ с парами воды. При высокой температуре около 1000 образуется смесь оксида углерода – угарного газа и водорода. Эту смесь называют синтез газ. Часто ее не разделяют, а используют для получения разных органических веществ.
Урок - изучение нового материала
«Химические свойства и применение алканов».
10 класс, продолжительность урока 45 минут.
Цель урока: Изучение химических свойств алканов, особенностей уравнений и условий протекания реакций с участием органических веществ. познакомить учащихся с основными областями применения алканов.
Задачи урока: формирование коммуникативных навыков, навыков само и взаимоконтроля, развитие умения применять полученные знания в сходной или новой ситуации, развитие интеллектуальных способностей.
Оборудование: мобильный класс, презентация «Химические свойства и применение алканов», таблица «Природный газ - химическое сырье», «синий» ящик- в нем газета, холодильник, газовый баллон, автомобильное колесо, машинка, катридж. На столе - свеча, загадки по применению алканов (Приложение № 4), на партах – рабочие листы (приложения 1,2,3), цветные листы бумаги (по количеству групп).
Оформление доски: слева - химические свойства алканов- уравнения реакций, дублируются из приложения № 2 (запись уравнений цветным мелом по цвету листов цветной бумаги на партах), справа- уравнения, иллюстрирующие химические свойства серной кислоты (основные), обе записи закрыты белыми листами разного размера, на обороте левой доски- таблица «Природный газ - химическое сырье», на обороте правой «ключ» к решению проверочного теста (приложение № 3).
Ход урока:
1. Организационно - мотивационный этап.(3-5 мин.)
Деятельность учителя
Деятельность учеников
Приветствие:
- «Здравствуйте, я приветствую вас на очередном уроке химии и рада видеть всех в классе. Устали? Нам сегодня на уроке понадобятся силы. Вот что говорит Дистервег по этому поводу «Развитие и образование ни одному человеку не могут быть даны или сообщены. Всякий, кто желает к ним приобщиться, должен достигнуть этого собственной деятельностью, собственными силами, собственным напряжением». А силы действительно пригодятся, т.к. нам предстоит сегодня разобраться с белыми пятнами на доске и вот этим синим ящичком. Готовы?
Приветствуют учителя, заинтригованы наличием свечи и бархатной шкатулки на столе, выражают готовность начать урок.
Прежде чем приступить к разгадыванию тайны двух белых пятен на доске, посмотрим, какие белые пятна в знаниях о предельных углеводородах есть у нас.
Учащиеся обращаются к рабочему листу, вклеенному у них в тетрадях на последней странице под названием «Знаю, умею» (Приложение 1), где знаками + или – отмечено усвоение материала и сообщают, что они не знают химические свойства алканов, особенности уравнений реакций и применение алканов.
Действительно, вот эти два вопроса нам и предстоит сегодня рассмотреть.
Записывают тему урока.
Скажите, от чего зависят химические свойства веществ?
От строения и состава вещества (пользуются подсказкой на рабочем листе «Знаю, умею», при необходимости)
Хорошо, какой состав имеют алканы?
Они состоят из двух химических элементов углерода и водорода.
Какое строение имеют данные углеводороды?
Все атомы в молекуле соединены одинарными связями.
Согласитесь, довольно несложное строение и состав имеют алканы. Может и химические свойства можно описать несложной химической реакцией, например, горение свечи (указываю на свечу на столе).
Соглашаются, ведь свеча- это твердый углеводород, который хорошо горит и можно определить продукты реакции.
Что ж, проверим и разберемся уже с этими белыми пятнами на доске. За ними спрятаны записи химических свойств веществ, с одной стороны – неорганического - серной кислоты, с другой- метана и его гомологов. Предположите, где и какие записи?
Дети указывают на небольшой лист справа, предполагая, что там записаны свойства алканов и, соответственно слева за большим листом - свойства серной кислоты.
Проверим (открывает белые листы).
Дети охают! и делают вывод, что вещества простого строения и состава не всегда имеют «простые» химические свойства.
Выражают интерес и желание подробно изучить все химические реакции и их особенности.
2. Информационно- поисковый этап.(20-25 мин.)
Деятельность учителя
Деятельность учеников
Порядок работы:
На столах лежат рабочие листы (Приложение № 2), в которых дублируется запись на доске (уравнения записаны рязноцветным мелом, а на партах- такие же листы цветной бумаги- это указатель, какие реакции рассматривает данная группа);
На рабочем столе компьютера – презентация «Химические свойства алканов», учебник;
- «Ваша задача: внимательно познакомиться с материалом презентации и учебника, дать полную характеристику «своим» реакциям и представить их классу, а также быть готовым к тому, что группы могут задать вопрос, если что-то в данной реакции им будет непонятно. Фиксируем информацию в свои рабочие листы»;
Время выполнения работы 10 минут.
Определились с группами и реакциями, которые им необходимо изучить и представить классу (по цветной бумаге). Внимательно изучают и просматривают презентацию, материал учебника, делают записи в свои рабочие листы, готовятся к выступлению, распределяют между собой реакции.
По истечении времени, приглашает группы по очереди представить свой материал.
Группы представляют материал, остальные фиксируют, задают вопросы, уточняют названия, особенности и условия реакций.
По окончании работы еще раз сравнить записи на доске и в своих рабочих листах.
Хорошо, с химическими свойствами разобрались, приступим к изучению применения алканов, в частности природного газа, не можем же мы без внимания оставить этот симпатичный синий ящичек! (демонстрирует таблицу «Природный газ – химическое сырье»). Рассмотрите области применения природного газа, пользуясь данной таблицей и рисунком в учебнике.
Изучают таблицу и рисунок в учебнике. С интересом поглядывают на синий ящичек на столе. Готовы перечислить области применения алканов.
- Для результативного подведения итогов предлагаю провести зарядочку сил
Дети выходят из-за парт и вместе с учителем выполняют упражнение: поднимаются на носки, поднимают руки вверх, при этом глубоко вдыхают, опускаясь- выдыхают (3-4 раза). После поворачивают голову влево-вправо и улыбаются соседу.
3. Оценочно- рефлексивный этап. (12-15 мин)
Деятельность учителя
Деятельность учеников
Выполняют тест индивидуально, подписывают листы.
Готовы проверить? (правильные ответы на развороте правой доски), отметьте количество правильных ответов и результат перенесите в лист «Знаю, умею» соответствующим знаком (все ответы правильные – знак + в графе Химические свойства алканов, правильно четыре ответа, знак - , если 3 , то -. Поделитесь своими результатами.
Проверяют ответы, отмечают в рабочем листе, анализируют и сообщают, какие недочеты или ошибки допустили, с чем справились или нет, что нужно еще дополнительно, самостоятельно изучить.
Листы сдают учителю.
Назовите области применения метана и его гомологов (приглашает одного из учеников помочь открыть синий ящик).
При затруднениях, учитель задает загадки (приложение № 4)
Ученик достает предметы из ящичка, дети по очереди называют предмет и вещество, которое используют для его изготовления или непосредственно область применения.
Молодцы и с применение алканов вы тоже справились, отметьте плюсом графу «Применение алканов» в листе «Знаю, умею».
Работают с рабочими листами
Запишите домашнее задание: сайт Химуля, урок 7-8, найти в данном материале то, чего сегодня на уроке мы не нашли.
Записывают домашнее задание.
Вопросы есть? Всем спасибо, до свидания.
Моими учениками и мной созданы презентации по различным классам углеводородов. Вашему вниманию представлена презентация по теме: "Алканы". Единственное, что видео, которые есть в презентации не будут показываться.
Скачать:
Предварительный просмотр:
https://accounts.google.com
Подписи к слайдам:
СТРОЕНИЕ,ИЗОМЕРИЯ, ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ. СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ.ПРИМЕНЕНИЕ. Работу выполнили: Котова Настя 10 В Айдынова Сюзан 10В Байшева Настя 10В Филимонов Денис 10В
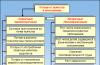
Вопрос Алканы Общая формула Гомологический ряд Строение Виды изомерии Физические свойства Химические свойства I . Замещение 1.Галогенирование 2.Нитрование II .Окисление III . Отщепление 1.Дегидрирование IV. Крекинг V . Изомеризация Получение Получение метана 1.Гидролиз карбида алюминия Общие способы получения алканов 1.Гидрирование алкенов и алкинов 2.Реакция Вюрца 3. Декарбоксилирование Применение
Гомологический ряд алканов C n H 2n+2
Строение алканов Простейшим представителем алканов является метан. Рассмотрим строение его молекулы. CH 4 - ковалентная полярная связь. 109 ° 28 ’ – угол между связями Длина связи C-H 0 . 109 нм C-C 0.154 нм ВИДЕО ВИДЕО
Виды изомерии алканов Для алканов характерна изомерия углеродного скелета ВИДЕО
Физические свойства Алканы имеют молекулярную кристаллическую решетку С 1 -С 4 - бесцветные газы С 5 -С 17 -бесцветные жидкости, имеющие запах бензина С 18 -твердые вещества
Химические свойства Для алканов характерны реакции: I. Замещения -Галогенирование свет CH 4 + Cl 2 → CH 3 Cl + HCl -Нитрование t СН 4 + HONO 2 → CH 3 NO 2 +H 2 O II .Окисление -Горение СН 4 +2О 2 →СО 2 + 2Н 2 О -Каталитическое окисление СН 3 ОН СН4 + [О] → НСОН НСООН
Химические свойства III .Отщепления 1. Дегидрирование t,Ni С 3 Н 8 →С 3 Н 6 + Н 2 1500 0 C 2СН 4 → С 2 Н 2 + 3Н 2 2. Пиролиз 1000 0 c СН 4 →С+ 2Н 2 IV. Крекинг 600 0 c С 8 Н 18 →С 4 Н 10 + С 4 Н 8 IV. Изомеризация t ,AlCl 3 СН 3 - СН 2 - СН 2 - СН 3 → СН 3 - СН - СН 3 / СН 3
Методы получения метана 1.Разложение карбида алюминия водой или кислотой. Al 4 C 3 +12H 2 O → 4Al(OH) 3 + 3CH 4 Al 4 C 3 +12H С l → 4AlCl 3 + 3CH 4 2 .Синтез из простых веществ t,Ni С + 2Н 2 →СН 4 3.Восстановление оксидов углерода: t,Ni СО + 3Н 2 → СН 4 + Н 2 О 4 . Декарбоксилирование CH 3 COONa + NaOH CH 4 + Na 2 CO 3
Способы получения 1.Гидрирование алкенов и алкинов (Ni,t) СН 2 =СН 2 +Н 2 → СН 3 -СН 3 СН ≡ СН + 2 Н 2 → СН 3 -СН 3 2 .Реакция Вюрца СН 3 С l + 2Na + CH 3 Cl → C 2 H 6 + 2NaCl
Применение Для получения: 1. Резины 2.Типографской краски 3.Синтетического бензина 4.Синтез-газа 5.Растворителей 6.Горючего 7.Хладаагентов
Ресурсы 1.И.И. Новошинский, Н.С.Новошинская «Органическая химия 11» 2. С D –диск «Виртуальная лаборатория, 9 класс» 3.С D -диск «Уроки химии Кирилла и Мефодия»
Предварительный просмотр:
Чтобы пользоваться предварительным просмотром презентаций создайте себе аккаунт (учетную запись) Google и войдите в него: https://accounts.google.com
Подписи к слайдам:
СТРОЕНИЕ,ИЗОМЕРИЯ, ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ. СПОСОБЫ ПОЛУЧЕНИЯ АЛКЕНОВ.ПРИМЕНЕНИЕ. Работу выполнили ученики 10 «В» класса Засова Катя, Рогожкина Алина Катюшин Толя под руководством Щербатых Н.В.
АЛКЕНЫ С n H 2n Молекулярная формула Название Тривиальное - - - C 2 H 4 Этен Этилен C 3 H 6 Пропен Пропилен C 4 H 8 Бутен Бутилен С 5 H 1 0 Пентен Пентилен ГОМОЛОГИЧЕСКИЙ РЯД АЛКЕНОВ
СТРОЕНИЕ АЛКЕНОВ Признаки Тип гибридизации Валентный угол Форма молекулы Длина связи АЛК ЕН Ы sp 2 - гибридизация 1 20 0 плоский треугольник 0,134нм
Изомерия алкенов Структурная изомерия Изомерия углеродного скелета(начиная с C 4 H 8). CH 2 CH-CH 2 -CH 3 CH 2 =C-CH 3 2- метилпропен Бутен -1 CH 3 Изомерия положения двойной связи в молекуле (начиная с C 4 H 8). С H 2 CH-CH 2 -CH 3 С H 3 - CH=CH-CH 3 Бутен-1 бутен-2 Межклассовая изомерия (начиная с С3 H 6) CH 2 =CH-CH 2 -CH 3 ← → H 2 C-CH 2 Бутен-1 H 2 C - CH 2 Циклобутан II Пространственная Геометрическая или цис-транс-изомерия, которая обусловлена различным положением заместителей относительно двойной связи C 4 H 8 C n H 2 n СН 3 -СН=СН-СН 3 ВИДЫ ИЗОМЕРИИ
Алкены имеют молекулярную кристаллическую решетку С 1 -С 4 - бесцветные газы С 5 -С 17 -бесцветные жидкости С 18 -твердые вещества Физические свойства алкенов
ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ Галогенирование CH 2 = CH 2 + Br 2 CH 2 – CH 2 Br Br 1, 2 – дибромэтан 2. Гидрирование протекает при умеренном нагревании, повышенном давлении и в присутствии металлических катализаторов (Pt, Pd или Ni) H 2 C = CH 2 + H 2 p, t, Ni H 3 C – CH 3 этен этан
ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ 3. Гидрогалогенирование H 2 С = CH 2 + Н Br CH 3 – CH 2 Br этен бромэтан Правило Марковникова: Атом водорода присоединяется к более гидрированному, а атом галогена – к менее гидрированному атому углерода при двойной связи. 4. Гидратация CH 2 = CH 2 + Н – ОН t, H 2 SO 4 СН 3 – СН 2 ОН этиловый спирт 5. Реакция полимеризации nCH 2 = CH 2 t, p, кат. (– CH 2 – CH 2 –) n
6. Горение C 2 H 4 +3O 2 2CO 2 + 2H 2 O Этилен с кислородом образует взрывоопасную смесь. 7. Реакция окисления 3 СН 2 = СН 2 + 2KMnO 4 + 4H 2 O 3CH 2 – CH 2 + 2KOH + 2MnO 2 OH OH ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ
ПОЛУЧЕНИЕ АЛКЕНОВ 1)Крекинг нефтепродуктов. C 16 H 34 C 8 H 18 + C 8 H 16 гексадекан октан октен 2)Дегидрирование предельных углеводов. CH 2 =CH-CH 2 -CH 3 +H 2 CH 3 -CH 2 -CH 2 -CH 3 бутен-1 CH 3 - CH = CH - CH 3 + H 2 бутен-2 3)Дегидратация спиртов (отщепление воды). H 2 SO 4 , 170-180 C CH 3 -CH 2 -OH CH 2 =CH 2 +H 2 O 4) Дегидрогалогенирование (отщепление галогеноводорода). Br спирт CH 3 -CH-CH 2 -CH 3 +NaOH CH3-CH=CH -СН 3 +NaBr+H2O 2-БРОМБУТАН бутен-2 5)Дегалогенирование. Br Br CH 3 -CH-CH-CH 3 +Zn CH 3 -CH=CH-CH 3 +ZnBr 2
Слайд 1
Описание слайда:
Слайд 2

Описание слайда:
Слайд 3

Описание слайда:
Слайд 4

Описание слайда:
Слайд 5

Описание слайда:
Слайд 6

Описание слайда:
Слайд 7

Описание слайда:
Слайд 8

Описание слайда:
Слайд 9

Описание слайда:
Слайд 10

Описание слайда:
Слайд 11

Описание слайда:
Слайд 12

Описание слайда:
Слайд 13

Описание слайда:
Слайд 14

Описание слайда:
Слайд 15

Описание слайда:
Слайд 16

Описание слайда:
Слайд 17

Описание слайда:
Слайд 18

Описание слайда:
Слайд 19

Описание слайда:
Слайд 20

Описание слайда:
Слайд 21

Описание слайда:
Слайд 22

Описание слайда:
Слайд 23

Описание слайда:
Слайд 24

Описание слайда:
Слайд 25

Описание слайда:
Слайд 26

Описание слайда:
Слайд 27

Описание слайда:
Слайд 28

Описание слайда:
Слайд 29

Описание слайда:
Слайд 30

Описание слайда:
Слайд 31

Описание слайда:
Слайд 32

Описание слайда:
Слайд 33

Описание слайда:
КАРБОНОВЫЕ КИСЛОТЫ Карбоновые кислоты - органические соединения, молекулы которых содержат одну или несколько карбоксильных групп -СООН, связанных с углеводородным радикалом. Изучение карбоновых кислот лучше начинать с рассмотрения одноосновных насыщенных кислот, общая формула которых Сп Н2п+1СООН. Карбоновые кислоты бывают одноосновные или монокарбоновые; по характеру углеводородного радикала различают предельные, непредельные и ароматические кмслоты. Названия карбоновых кислот по систематической номенклатуре производчт от названия предельных углеводородов с добавлением окончания –овая и слова кислота.Нумерацич главной цепи начинается с углерода, входящего в состав карбоксильной группы.
Слайд 35

Описание слайда:
Слайд 36

Описание слайда:
Слайд 37

Описание слайда:
Сложные эфиры, R-COOR" - производные карбоновых кислот, в которых гидраксильная группа –ОН карбоксила замещена на группу OR‘. Их получают при взаимодействии карбоновой кислоты со спиртом (катализатор – сильная кислота): Сложные эфиры, R-COOR" - производные карбоновых кислот, в которых гидраксильная группа –ОН карбоксила замещена на группу OR‘. Их получают при взаимодействии карбоновой кислоты со спиртом (катализатор – сильная кислота): Образование сложного эфира из кислоты и спирта называется реакцией этерификации. Это обратимый процесс. Обратная реакция - гидролиз сложного эфира. Установлено, что при этерификации от кислоты отщепляется гидроксил, а от спирта водород (т.е. спирт выступает в качестве нуклеофила, образуя связь с карбонильным атомом углерода за счет своей неподеленной электронной пары). Амиды (R-CONH2) – производные карбоновых кислот, в которых гидроксильная группа –ОН замещена на аминогруппу –NH2. Амиды получают при взаимодействии кислот с аммиаком при нагревании для разложения образующейся аммониевой соли.
Описание слайда:Аминокислоты Аминокислоты - органические соединения, содержащие в молекуле два типа функциональных групп: карбоксильную -СООН, и аминогруппу -NН2, т.е относится к гетерофункциональным соединениям. Аминокислоты можно также рассматривать как производные карбоновых кислот, содержащих в радикале одну или несколько аминогрупп. Аминокислоты играют огромную роль в жизни животных и растительных организмов, так как являются теми структурными элементами, из которых построены молекулы важнейшего природного полимера - белка - основы всего живого. Классифицируются аминокислоты по взаимному расположению функциональных групп, по числу и характеру функциональных групп, по химической природе радикала R -аминокислот. Для аминокислот применима международная номенклатура (ИЮПАК), но чаще используют тривиальные названия. Тривиальные названия -аминокислот обычно связаны с источником выделения.
Слайд 41

Описание слайда:
Слайд 42

Описание слайда:
С катионами тяжелых металлов а -аминокислоты как бифункциональные соединения, образуют внутрикомплексные соли, например, со свежеприготовленным гидроксидом меди (П) в мягких условиях получаются хорошо кристаллизующиеся хелатные С катионами тяжелых металлов а -аминокислоты как бифункциональные соединения, образуют внутрикомплексные соли, например, со свежеприготовленным гидроксидом меди (П) в мягких условиях получаются хорошо кристаллизующиеся хелатные соли меди (П) синего цвета (от греч. "хела" - клешня). Эти комплексы хорошо растворимы в воде, в некоторых органических растворителях и широко используются для обнаружения - аминокислот в аналитической химии. Благодаря своей амфотерности аминокислоты в живом организме играют роль буферных веществ, поддерживающих определенную концентрацию водородных ионов.
Слайд 43

Описание слайда: